植物組織中ATP酶活力的測定
簡介
了解ATP酶在植物代謝過程中的作用,掌握ATP酶活力測定的原理和方法。
原理
ATP酶(adenosine triphosphatase)可催化ATP水解生成ADP及無機磷,這一反應放出大量能量,以供生物體進行各需能生命過程。它存在于生物細胞的多個部位,如細胞質膜上、葉綠體類囊體膜上,對整個生命的維持有著重要的作用。在生物學研究中,常通過測定酶促反應釋放的無機磷量或ATP的減少量以及pH變化等來測定ATP酶的活力。
本實驗通過測酶促反應過程中無機磷的釋放量來測定葉綠體偶聯因子ATPase的活力。偶聯因子是分布在葉綠體類囊體膜表面的一種復合蛋白,它在光合作用能量轉換反應中起重要作用。
在正常情況下,膜上的偶聯因子催化光合磷酸化反應(ATP合成)的速率很高,而水解ATP的活力是十分低的,但用二硫蘇糖醇(DTT)、胰蛋白酶或較高溫度等激活后。它水解ATP的活力可大大增加。因此,偶聯因子的測定常用激活后的ATPase水解ATP的活力來表示。
材料與儀器
材料:新鮮菠菜葉片。
試劑:
①1 mol · L-1 Tris-HCl 緩沖液(pH 8.0):稱 57 g Tris 溶于 400 mL 蒸餾中,用濃鹽酸調至pH 8.0,再加蒸搐水至500 mL。
②5 mol?L-1硫酸溶液:取27. 8 mL(相對密度1.84)濃硫酸,慢慢加入70 mL蒸餾水中,冷卻后定容至100 mL。
③10% 硫酸鑰酸鉉溶液:稱10 g鑰酸鏤溶于100 mL 5 mol?L-1硫酸中。
④硫酸亞鐵-鑰酸鉉試劑:稱5 g硫酸 亞鐵,加入10 mL硫酸鑰酸鉉,再加蒸餡水稀釋到70 mL,直至溶解為止(用前臨時配制)。
⑤STN緩沖液,將0.05 mol · L-1 Tris-HCl pH 7.8緩沖液(內含0.4 mol?蔗糖溶液、 0.01 mol · L-1 NaCl溶液)放入冰箱中預冷。
器材:分光光度計,水浴鍋,照光設備(光源50 000 lx),臺式離心機。
步驟
植物組織中ATP酶活力的測定的基本過程可分為如下幾步:
(一)葉綠體制備
1. 取準備好的菠菜葉5 g置于研缽或組織搗碎機杯中,加入20 mL 0°C下預冷的STN緩沖 液,很快研磨或搗碎(0.5 min完成),做成勻漿,以4層紗布過濾去粗渣,濾液于0~2°C下, 200 g離心約1 min,去細胞碎片,將上清液再于1500 g離心5~7 min,取沉淀懸浮于少量 STN(pH 7.8)中,使葉綠素含量在0.5 mg · mL-1左右。
(二)ATP酶的激活
1. MgH-ATP酶激活液及反應液配制(表37-1)。
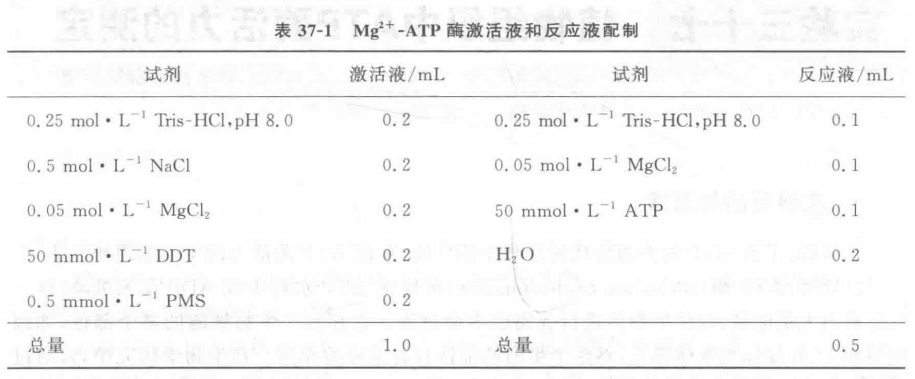
2. 激活過程:取已制備好的葉綠體懸浮液1 mL(葉綠素含量約為1 mg · mL-1),加入 1 mL激活液,于室溫在白熾光50000 lx下進行光激活6 min。
3. 反應過程:取3支試管,分別加入上述激活后的葉綠體懸浮液各 5 mL,再加入 0.5 mL的反應液,取兩支管置37 °C水浴中(另一支管置冰浴中作空白用)保溫10 min,各加 入0.1 mL 20% 的三氯乙酸停止反應。用臺式離心機離心后各取上清液0.3~0.5 mL(取樣量按活力大小而改變)供測定ATP水解的無機磷用。
(三) 無機磷的測定
取反應后經離心的上清液0.5 mL加入2. 5 mL蒸餾水,搖勻后加入2 mL硫酸亞鐵鑰酸鉉試劑,于室溫放置1 min后顯色即穩定,置分光光度計上用660 nm比色測定吸光度。
(四) 結果計算
ATP酶活力的計算,按表37-2配制不同濃度的無機磷標準液,于分光光度計上用 660 nm比色測定吸光度。以無機磷濃度作橫坐標,所測得的吸光度作縱坐標繪制標準曲線, 按下式計算ATP酶活力:

式中s一從標準曲線上查得的無機磷含量,μ mol;
Vr—反應體積,mL;
W一葉綠素的質量,mg;
Vs —測定時取用體積,mL;
t—反應時間,min。
注意事項
1 .制備葉綠體懸液時,加入懸浮介質速度要緩慢,以便保持葉綠體的完整度。
2. ATP酶激活的條件。


