超氧化物歧化酶(SOD)活力測定
簡介
學習和掌握氯化硝基四氮哩藍(NBT)光化還原法測定SOD活力的方法和原理。并了解SOD的作用特性。
原理
1. 植物在逆境脅迫或衰老過程中,細胞內(nèi)自由基代謝平衡被破壞而有利于自由基的產(chǎn)生。自由基是具有未配對價電子的原子或原子團。生物體內(nèi)產(chǎn)生的自由基主要有超氧自由基(O2-?)、羥自由基(OH?)、過氧自由基(ROD)、烷氧自由基(RO)等。
植物細胞膜有 酶促和非酶促兩類過氧化物防御系統(tǒng),超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、過氧化物 酶(POD)和抗壞血酸過氧化物酶(ASA-POD)等是酶促防御系統(tǒng)的重要保護酶。抗壞血酸 (維生素C)、維生素E和還原型谷胱甘肽(GSH)等是非酶促防御系統(tǒng)中的重要抗氧化劑。 CAT等活性氧清除劑的含量水平以及O2-?、H2O2、OH · 和O2等活性氧的含量水平可作為植物衰老的生理生化指標。
超氧化物歧化酶(superoxide dismutase,SOD)是含金屬輔基的酶。高等植物含有兩種類 型的SoD:Mn-SOD和Cu. Zn-SOD,它們能通過歧化反應清除生物細胞中的超氧自由基 (O2-?),生成 H2O2 和 O2。H2O2由過氧化氫酶(CAT)催化生成H2O和O2。從而減少自由基對有機體的毒害。反應式如下:
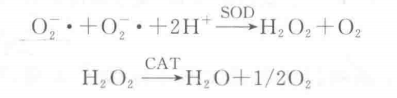
由于超氧自由基(O廣)為不穩(wěn)定自由基,壽命極短,測定SOD活性一般為間接方法,并利用各種呈色反應來測定SOD的活力。核黃素在有氧條件下能產(chǎn)生超氧自由基負離子O2-?,當加入NBT后,在光照條件下,與超氧自由基反應生成單甲膳(黃色),繼而還原生成二甲臘,它是一種藍色物質(zhì),在560 nm波長下有最大吸收峰。
當加入SOD時,可以使超氧自由基與H+結(jié)合生成H2O2和O2,從而抑制了NBT光還原的進行,使藍色二甲臘生成速度減慢。通過在反應液中加入不同量的SOD酶液,光照一定時間后測定560 nm波長下各液光密度值,抑制NBT光還原相對百分率與酶活性在一定范圍內(nèi)呈正比,以酶液加入量為橫坐標, 以抑制NBT光還原相對百分率為縱坐標,在坐標紙上繪制出二者的相關曲線,根據(jù)SOD抑 制NBT光還原相對百分率計算酶活性。找出SOD抑制NBT光還原相對百分率為50% 時的酶量作為一個酶活力單位(U)。
材料與儀器
1. 材料:小麥、玉米、水稻、棉花等新鮮葉片。
2. 試劑。
(1) 0.1 mol ? L-1pH 7.8 磷酸鈉(N2HPO4-NaH2PO4)緩沖液:
A液(0.1 mol - L-1 Na2HPO4溶液):準確稱取Na2HPO4?12H2O (相對密度為 358.14)3.5814 g于100 mL小燒杯中,用蒸餾水溶解后,移入100 mL容量瓶中用蒸餾水定容至刻度,充分混勻。4 °C冰箱中保存?zhèn)溆谩?/span>
B液(0.1 mol?L-1 NaH2PO4溶液):準確稱取NaH2PO4?2H2O (相對密度為156.01) 0. 780 g于50 mL小燒杯中,用少量蒸餾水溶解后,移入50 mL容量瓶中用蒸餾水定容至刻 度,充分混勻。4°C冰箱中保存?zhèn)溆谩?/span>
取上述A液183 mL與B液17 mL充分混勻后即為0.1 mol · L-1 pH 7. 8的磷酸鈉緩沖液。4 °C冰箱中保存?zhèn)溆谩?/span>
(2) 0.026 mol · L-1蛋氨酸(Met)磷酸鈉緩沖液:準確稱取L-蛋氨酸(C5H11NO2S,相對密度為149.21)0.3879 g于100 mL小燒杯中,用少量0.1 mol · L-1 pH 7. 8的磷酸鈉緩沖 液溶解后,移入100 mL容量瓶中并用0.1 mol · L-1 pH 7. 8的磷酸鈉緩沖液定容至刻度,充 分混勻(現(xiàn)用現(xiàn)配)。4 °C冰箱中保存可用1~2d。
(3)7.5×10-4 mol?L-1NBT溶液:準確稱取NBT(C4OH3OCl2N10O6,相對密度為 817. 7)0. 153 3 g于100 mL小燒杯中,用少量蒸餾溶解后,移入250 mL容量瓶中用蒸餾水定容至刻度,充分混勻(現(xiàn)配現(xiàn)用)。4°C冰箱中保存可用2~3 d。
(4)含 1.0 μmol ? L-1EDTA 的 2×10-5 mol . L-1 核黃素溶液:
A液:準確稱取EDTAC相對密度為292)0. 00292 g于50 mL小燒杯中,用少量蒸餾水溶解。
B液:準確稱取核黃素(相對密度為376.36)0.0753 g于50 mL小燒杯中,用少量蒸餾水 溶解。
C液:合并A液和B液,移入100 mL容量瓶中,用蒸個水定容至刻度,此溶液為含 0.1 mmol · L-1EDTA的2 mmol · L -1核黃素溶液。該溶液應避光保存,即用黑紙將裝有該液的棕色瓶包好,置于4°C冰箱中保存可用8-10 d。
當測定SOD酶活時,將C液稀釋100倍,即為含1.0 μnmol · L-1 EDTA的2X10-5mol · L-1 核黃素溶液。
(5)0.05 mol · L-1 pH 7.8磷酸鈉緩沖液:取0.1 mol · L-1 pH 7.8的磷酸鈉緩沖液 50 mL,移入100 mL容量瓶中用蒸餾水定容至刻度,充分混勻。4°C冰箱中保存?zhèn)溆谩?/span>
(6)石英砂。
3.器材:分光光度計,分析天平,高速冷凍離心機,冰箱,4500 lx光照箱,帶蓋瓷盤,移液 管架,研缽,5 mL離心管,10~15 mL微燒杯,0.5 mL、1 mL、2 mL、5 mL移液管或加樣器, 50 μL、100 μL 微量進樣器,50 mL、100 mL、500 mL、1 000 mL 燒杯,50 mL、100 mL 量筒, 50 mL、100 mL、250 mL、1000 mL 容量瓶,125 mL 細口瓶。
步驟
超氧化物歧化酶(SOD)活力測定的基本過程可分為如下幾步:
1. 酶液的制備:按每克鮮葉加入3 mL 0.05 mol · L-1pH 7. 8磷酸鈉緩沖液,加入少量石 英砂,于冰浴中的研缽內(nèi)研磨成勻漿,定容到5 mL刻度離心管中,于8 500 r · min-1: (10 000 g)冷凍離心30 min,上清液即為SOD酶粗提液。
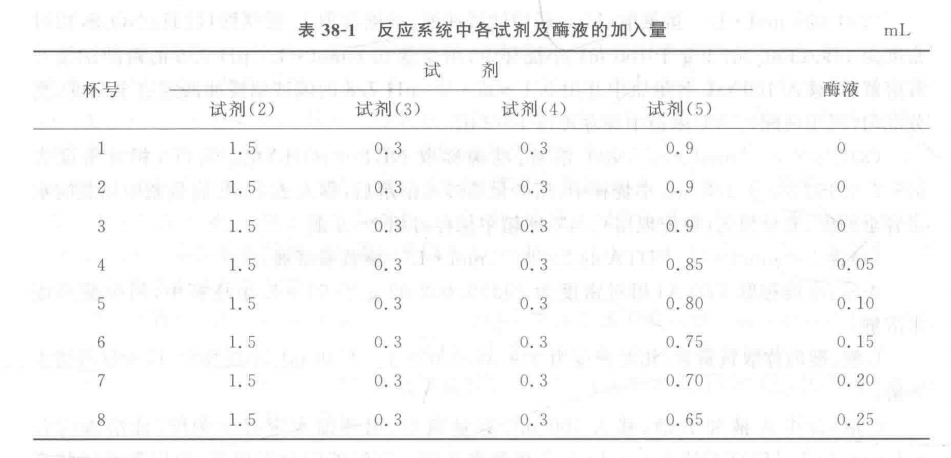
2. 酶活力的測定:每個處理取8個洗凈干燥好的微燒杯編號,按表38-1加入各試劑及酶液,反應系統(tǒng)總體積為3 mL。其中4~8號杯中磷酸鈉緩沖液量和酶液量可根據(jù)試驗材料中酶液濃度及酶活力進行調(diào)整(如酶液濃度大、活性強時,酶用量適當減少)。
各試劑全部加入后,充分混勻,取1號微燒杯置于暗處,作為空白對照,比色時調(diào)零用。 其余7個微燒杯均放在溫度為25 °C ,光強為4 500 lx的光照箱內(nèi)(安裝有3根20 W的日光燈 管)照光15 min,然后立即遮光終止反應。在560 nm波長下以1號杯液調(diào)零,測定各杯液光 密度并記錄結(jié)果。以2、3號杯液光密度的平均值作為抑制NBT光還原率100%,根據(jù)其他各 杯液的光密度分別計算出不同酶液量的各反應系統(tǒng)中抑制NBT光還原的相對百分率。以酶 液用量為橫坐標,以抑制NBT光還原相對百分率為縱坐標,作出二者相關曲線。找出50% 抑制率的酶液量(ptL)作為一個酶活力單位(U)。
1. 結(jié)果計算:
(1)測560 nm波長下各杯液的光密度填于表38-2中。

以酶液加入量為橫坐標,以抑制NBT光還原相對百分率為縱坐標,在坐標紙上繪制出二 者相關曲線。找出50% 抑制率的酶液量(卩L)作為一個酶活力單位(U)。
(2)SOD酶活力按下式計算:
V一酶提取液總體積,mL;
B——個酶活力單位的酶液量,μL;
W一樣品鮮重,g;
T一反應時間,min;
1 000—1 mL=1000 μL
60一1 h=60 min。
抑制率按下式計算:
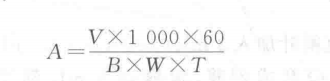
式中:9—2、3號杯液的光密度平均值;
D?一加入不同酶液量的各杯液的光密度值。
注:有時因測定樣品的數(shù)量多,每個樣品均按此法測定酶活力工作量將會很大,也可每個 樣品只測定1個或2個酶液用量的光密度值,按下式計算酶活力。
式中:D1一2、3號杯液的光密度平均值;
D2 -測定樣品酶液的光密度;
50% —抑制率為50% ;
其他各因子代表的內(nèi)容與上述SOD酶活力計算公式的各因子代表的內(nèi)容相同。
注意事項
1. 富含酚類物質(zhì)的植物(如茶葉)在勻漿時產(chǎn)生大量的多酚類物質(zhì),會引起酶蛋白不可逆沉淀,使酶失去活性,因此在提取此類植物SOD酶時,必須添加多酚類物質(zhì)的吸附劑,將多酚 類物質(zhì)除去,避免酶蛋白變性失活,一般在提取液中加1% ~4% 的聚乙烯毗咯烷酮(PVP)。
2. 測定時的溫度和光化反應時間必須嚴格控制一致。為保證各微燒杯所受光強一致,所有微燒杯應排列在與日光燈管平行的直線上。


