過氧化氫酶(POD)活性的測定
簡介
掌握比色法測定過氧化物酶活性的原理及方法。
原理
過氧化物酶(POD)催化過氧化氫氧化酚類的反應(yīng),產(chǎn)物為醍類化合物,此化合物進(jìn)一步縮合或與其他分子縮合,產(chǎn)生顏色較深的化合物。本實驗以鄰甲氧基苯酚(即愈創(chuàng)木酚)為過氧化物酶的底物,在此酶存在下,H2O2將鄰甲氧基苯酚氧化成紅棕色的4-鄰甲氧基苯酚,該物質(zhì)可用分光光度計在470 nm處測定其吸光值,即可求出該酶的活性。其反應(yīng)為: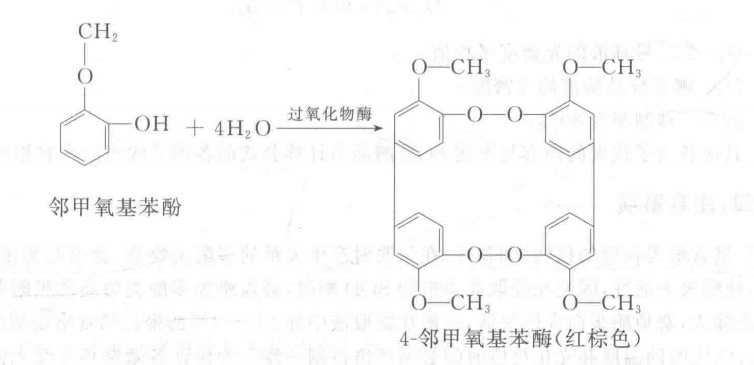
材料與儀器
材料:水稻根系、馬鈴薯塊莖等。
試劑:
(1)0.1 mol · L-1 Tris-HCl 緩沖液(pH 8.5):取 12.114 g 三羥甲基氨基甲烷(Tris),加 水稀釋,用 HCl 調(diào)pH 8.5后定容1000 mL。
(2)2 mol · L-1 磷酸緩沖液(pH 6. 0):
貯備液 A:0.2 mol · L-1 NaH2PO4 溶液(27.8 g NaH2PO4 · H2O 配成 1000 mL)。
貯備液 B:0.2 mol · L-1 Na2 HPO4 溶液(53. 65 g Na2 HPO4 · 7H2O 或 71.7 g Na2HPO4 · 12H2 O 配成 1000 mL ) o
分別取貯備液A 87.7 mL與貯備液B 12.3 mL充分混勻并稀釋至200 mL。
反應(yīng)混合液:取 2 mol?L-1磷酸緩沖液(pH 6.0) 50 mL、過氧化氫0.028 mL、愈創(chuàng)木酚0.019 mL混合。
3.器材:分光光度計,移液管,離心機(jī),秒表,研缽,天平等。
步驟
過氧化氫酶(CAT)活性的測定的基本過程可分為如下幾步:
1. 酶液提取:取不同水稻根系(根系表面水分吸干)1 g,剪碎置于研缽中,加5 mL 0.1 mol · L-1 Tris-HCl緩沖液(pH 8.5),研磨成勻漿,以4000 r?min-1離心5 min,傾出上清液,必要時殘渣再用5 mL緩沖液提取一次,合并兩次上清液,保存在冰箱(或冷處)備用。
2. 取光徑1 cm比色杯2個在其中1個中加入反應(yīng)混合液3 mL和磷酸緩沖液1 mL(或加熱煮沸5 min的酶液),作為校零對照,另1個中加入反應(yīng)混合液3 mL,上述酶液1 mL(如酶活性過高可稀釋之),立即開啟秒表記錄時間,用分光光度計在波長470 nmT測量吸光度值, 每隔1 min(60 s)讀數(shù)1次共測3 min。
3. 結(jié)果計算:以每分鐘光密度變化(以每分鐘人以A470為 0.01個活力單位)表示酶活性大小,即
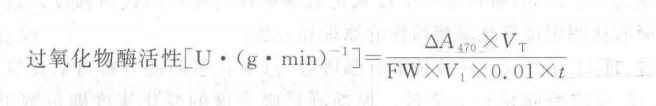
式中:A470—反應(yīng)時間內(nèi)吸光度的變化;
Vt一粗酶提取液總體積,mL;
V1一測定用粗酶液體積,mL;
FW—樣品鮮重,g;
0.01—A470 每下降0.01為1個酶活單位,U;
t一反應(yīng)時間,min。
注意事項
1. 酶的提取、純化需在低溫下進(jìn)行。
2. H2O2要在反應(yīng)開始前加,不能直接加入。
3 .酶促反應(yīng)較快,計時應(yīng)準(zhǔn)確、快速。


