磷酸烯醇式丙酮酸羧化酶活性的測定
簡介
磷酸烯醇式丙酮酸羧化酶活性的測定是了解磷酸烯醇式丙酮酸(PEP)梭化酶的功能,熟悉酶偶聯法測定 PEP 稜化酶活性的方法。
原理
磷酸烯醇式丙酮酸羧化酶活性的測定的基本原理是PEP梭化酶是 C4 植物和 CAM 植物固定 CO2 的關鍵酶。在 Mg2+ 存在下,PEP 梭化酶可催化 PEP 與 HCO3- 形成草酰乙酸(OAA),后者在蘋果酸脫氫酶(MDH)催化下,可被 NADH 還原為蘋果酸(Mal)。其反應如下:
通過在 340 nm 處測定反應體系吸光度的變化,計算出 NADH 的消耗速率,進一步推算出 PEP 梭化酶的活性。
材料與儀器
材料:玉米、高粱等 C4 植物的葉片。
試劑:
提取緩沖液:0.1 mol?L-1 Tris-H2SO4 緩沖液(pH7.4),內含 7 mmol?L-1 疏基乙醇、1 mmol?L-1 EDTA、5% 甘油;
平衡緩沖液:10 mol?L-1 Tris-H2SO4 緩沖液(pH8. 2),內含 0.2 mmol?L-1 EDTA、 0.2 mol?L-1 DTT(二硫蘇糖醇)、5% 甘油;
反應緩沖液:0.1 mol?L-1 Tris-H2SO4 緩沖液(pH9.2),內含 0.1 mol?L-1 MgCl2;
反應試劑:100 mmol?L-1 NaHCO3、40 mmol?L-1 PEP、1 mg?L-1 NADH(pH8.9)、蘋果酸脫氫酶(MDH)。
器材:
① 紫外分光光度計
② 冷凍離心機
③ 組織搗碎機
④ Sephadex G-25 柱(2 cm × 45 cm)
⑤ DEAE(二乙氨乙基)-纖維素(DE-52,1 cm × 30 cm)柱
⑥ 紫外監測儀
⑦ 部分收集器
⑦ 蠕動泵
步驟
磷酸烯醇式丙酮酸裝化酶活性的測定的基本過程可分為如下幾步:
1. 粗酶液提取
將葉片洗凈并吸去水分,去掉中脈。稱取 20 g,放入冰箱中過夜,次日剪碎 后放入組織搗碎機中,加入提取緩沖液(已預冷)80 mL,20 000 r/min 勻漿 2 min(運行 30 s、間歇 10 s,反復勻漿),用 4 層紗布過濾,取濾液于高速冷凍離心機上 15 000 g 離心 10 min,上清液即為 PEP 梭化酶的粗酶提取液。
2. 酶的純化
(1) 硫酸鉉分步沉淀:將上述粗酶液裝入燒杯,于攪拌器上攪拌,緩慢加入固體硫酸鉉粉末達到 35% 飽和度,在冰箱中靜置 1 h, 于 15 000 g 下離心 10 min,取上清液再緩慢加入固體硫酸鉉粉末達到 55% 飽和度,冰箱靜置 1 h,再于 15 000 g 下離心 10 mm,棄上清液,沉淀用平衡緩沖液 8 mL 復溶。
(2)Sephadex G-25 柱層析:先用平衡緩沖液平衡 Sephadex G-25 柱(2 cm × 45 cm)。將上述復溶溶液上柱,壓樣 2 次,用平衡緩沖液洗脫,洗脫速度為 50 mL?h-1,通過檢測儀,收集有酶活性的部分,于 15 000 g 下離心 10 min,上清液即為 PEP 梭化酶的部分純化酶液。
(3)DEAE-纖維素柱層析:把轉型的 DEAE-52 裝入 1 cm × 30 cm 的層析柱,用平衡緩沖液平衡 2 h,將上述已部分純化的酶液上 DEAE-52 柱,壓樣 2 次,用平衡緩沖液洗脫,通過紫外檢測儀后收集。再用平衡緩沖液配制 0~0.6 mol?L-1 NaCl 溶液進行連續性梯度洗脫(速度為 30 mL?h-1),收集有酶活性的部分即為純化的 PEP 侵化酶,用于酶活的測定。
3. 酶活測定
取試管 1 支,依次加入 1.0 mL 反應緩沖液,0.1 mL 40 mmol?L-1 PEP,0.1 mL 1 mg?mL-1 NADH(pH8.9),0.1 mL 蘋果酸脫氫酶和 0.1 mL PEP 梭化酶(已純化的提取液),1.5 mL 蒸餾水,在所測溫度(如 30 ℃)下恒溫水浴保溫 10 min,在 340 nm 下測定吸光度值 A340(A0);然后加入 0.1 mL 100 mmol?L-1 NaHCO3 啟動反應,立即計時,每隔 30 s 測定一次吸光度值(A1),記錄其變化。
4. 實驗結果
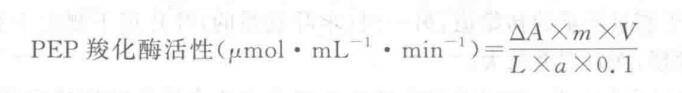
式中:V—測定混合液總體積,3 mL;
L 一比色杯光程,cm;
0.1 一反應混合液中酶液用量,mL;
m 一酶液稀釋倍數;
△A = A0 - A1;
a一 NADH 于 340 nm 處的摩爾消光系數(6.22 × 103 mol-1?cm-1)。
注意事項
1. 酶提取過程應在 0~4 ℃ 下進行。
2. 測定時的酶液用量需事先試驗,蘋果酸脫氫酶的用量視 PEP 梭化酶活性大小而定,也可事先通過實驗確定最佳用量。


