免疫共沉淀質譜
簡介
免疫共沉淀是一種用于從復雜混合物中富集或純化特定蛋白質的技術,然后結合質譜可以鑒定特定蛋白的相互作用蛋白,本方法講述從細胞裂解到質譜制樣的步驟。
用途
利用質譜技術強大的蛋白質定性能力,檢測蛋白質相互作用組學。
材料與儀器
細胞裂解液
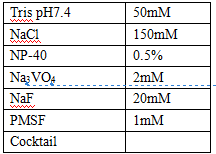
pH 7.4 無菌 PBS、特異性抗體
蛋白質 A/G
用于蛋白質印跡分析的上樣/樣品緩沖液
乙腈、碳酸氫銨、純水、DTT、碘乙酰胺
步驟
對于懸浮細胞:
1, 將待裂解的細胞輕輕地轉移至預冷的微量離心管中,用預冷的 PBS 洗滌細胞一次。
2, 離心棄去 PBS,然后加入預冷的裂解緩沖液(對于每 107 個細胞加入 1 ml)。
3, 在 4 ℃ 下以恒定速率混勻 5~20 min,使充分裂解。
4, 在 4 ℃ 下 14000 g 離心 10 min,吸出上清液并將其注入置于冰上的潔凈管中,然后棄去沉淀物。
對于貼壁細胞:
1, 棄去培養(yǎng)基,用冰預冷的 PBS 洗滌細胞一次。
2, 去除 PBS,加入預冷的細胞裂解液,在冰上孵育 5 min。
3, 從培養(yǎng)皿上刮下細胞,并轉移至 EP 管中。
4, 14000 g,4 °C 離心 10 min,然后將上清液轉移到新的 EP 管中。
5, 預清洗裂解物:向 1 mL 裂解物中加入 50 μL 來自相同物種和同亞型的非目標抗體作為免疫沉淀抗體,在冰上孵育 1 h。
6, 4 °C, 5000 g 離心 10 min 棄去微珠沉淀物,保存上清液進行免疫沉淀。
7, 抗體孵育:向微量離心管中加入約 70~100 μL 的蛋白質 A 或 G,加入 10 μL 一抗 (需根據(jù)抗體濃度計算)。
8, 在 4 °C 下,翻轉混合儀輕輕混勻抗體-微珠混合物,并孵育 1~4 小時。
9, 在 4 °C 下以 1000~3000 g 離心 2 分鐘,然后棄去上清液。
10, 洗滌:加入 1 mL 裂解緩沖液上下顛倒重懸微珠,然后在 4 °C 下以 3000 g 離心 2 分鐘。重復此洗滌步驟兩次。
11, 加入 40 μL 蛋白上樣緩沖液,95 °C 加熱 5 min 以洗脫樣品。
12, SDS-PAGE 電泳跑膠:選擇合適濃度的膠,進行電泳分離。
13, 切下包括溴酚藍在內(nèi)的膠塊,純水清洗三次,用小刀片將膠塊切成 1 mm × 1 mm 的小膠粒,裝入潔凈的 EP 管,膠粒可在 -80 °C 保存數(shù)月。
質譜制樣
1, 膠粒脫色:1 ml 純水清洗膠粒一次,移液槍去除上清。加入 1 ml 50% 乙腈的 25 mM 碳酸氫銨溶液,室溫振蕩 5 min 后去除上清,重復一次。
2, 膠粒脫水:加入 1 ml 純乙腈吹打膠粒,膠粒會立馬變白,室溫振蕩孵育 10 min 后去除乙腈,置于真空干燥儀 37 °C 10 min。
3, 還原:加入 1 ml 25 mM 碳酸氫銨配制的 50 mM DTT 溶液,56 °C 振蕩孵育 1 h。
4, 烷基化:DTT 還原結束后,冷卻至室溫,迅速加入 1 ml 25 mM 碳酸氫銨配制的 20 mM 碘乙酰胺溶液,抽屜避光靜置 45 min。
5, 重復步驟 1 和 2 清洗膠粒,用于胰酶消化樣品。
6, 胰酶消化:用 200 μl 25 mM 碳酸氫銨配制 0.5 ug 的胰酶,加入干燥的膠粒中,冰上靜置 10 min,待膠粒吸收酶液后,置于 37 °C 振蕩消化約 4~10 h。
7, 吸取膠粒上清轉移到新的 EP 管,并用 200 μl 的 50% 乙腈的 25 mM 碳酸氫銨溶液清洗膠粒兩次,合并到 EP 管中,置于真空干燥儀直至烘干,烘干的樣品可以在 -80 °C 保存數(shù)年。
注:也可使用磁珠通過磁性分離方法進行免疫沉淀實驗。
注意事項
a. 細胞裂解完成后,需要對蛋白質裂解產(chǎn)物進行預清洗。
b. 微珠的蛋白 A/G 包被要根據(jù) IP 抗體的來源物種與血清型來選擇。
c. 富集特定帶標簽的蛋白也可以使用標簽抗體偶聯(lián)的微珠。
d. 質譜樣品制備一定要完成還原和烷基化。
e. 推薦用低吸附 EP 管進行實驗。
f. 盡量避免接觸塑料制品,實驗中避免污染
常見問題
A. 高背景:20000 g 離心去除裂解液中的不溶物,微珠預處理裂解物。
B. 質譜鑒定到的蛋白少:加入新鮮的蛋白酶抑制劑,加大樣品的蛋白濃度。洗脫液 BCA 定量,蛋白濃度應大于 0.1 μg/μL。


