染色質免疫共沉淀測序(chip-seq)
簡介
染色質免疫沉淀技術(Chromatin immunoprecipitation assay, ChIP)是目前唯一研究體內 DNA 與蛋白質相互作用的方法,主要包括 ChIP-qPCR 和 ChIP-seq 兩種。利用 ChIP-seq 技術能夠高效地在全基因組范圍內檢測與組蛋白修飾、轉錄因子等互作的 DNA 區段。
原理
真核生物的基因組 DNA 以染色質的形式存在。使用甲醛將目的蛋白和 DNA 交聯固定,并通過超聲處理或核酸酶消化使染色質碎裂;再利用抗體特異性沉淀分離組蛋白或轉錄因子等及其結合的染色質,即染色質免疫共沉淀產物;通過蛋白酶解交聯,使目的蛋白與 DNA 分開,純化 DNA 后通過下一代測序 (NGS) 技術檢測和定量富集的 DNA 片段。
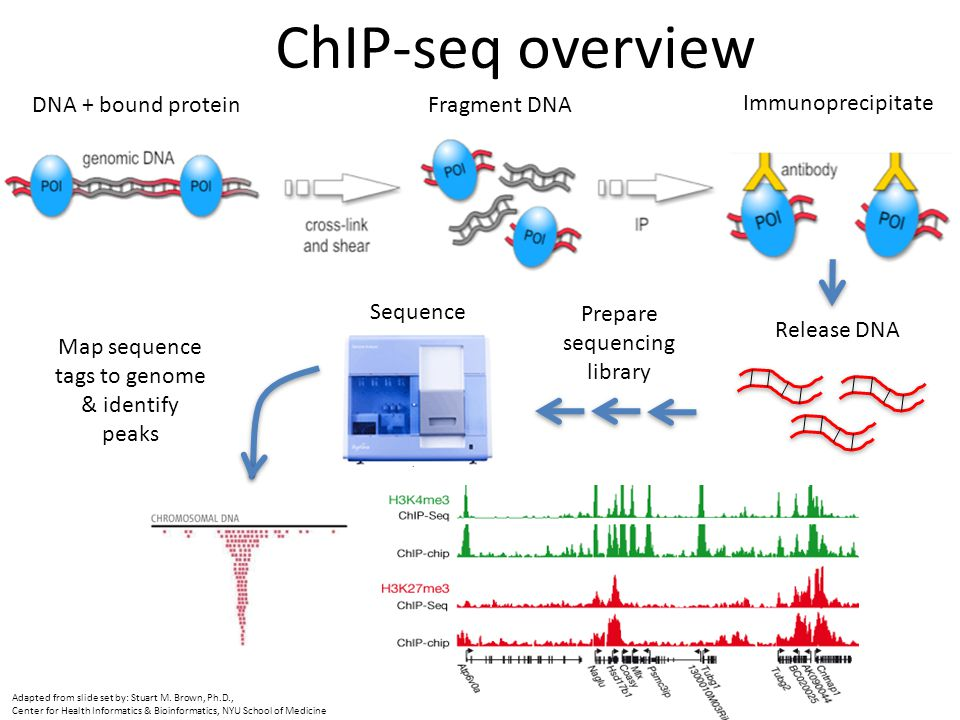
用途
用于分析與目的蛋白(轉錄因子或組蛋白)相互作用的 DNA 片段。
材料與儀器
甲醛、甘氨酸、預冷的 PBS、ChIP 裂解緩沖液、洗脫緩沖液、氯化鈉、RNase、蛋白酶 K、Tris-EDTA (TE)、100 bp DNA marker、 1.5% 瓊脂糖凝膠、RIPA 緩沖液、一抗、Protein A/G 磁珠、低鹽洗滌緩沖液、高鹽洗滌緩沖液、氯化鋰洗滌緩沖液。
步驟
1.DNA-蛋白質交聯和收集細胞
用甲醛交聯蛋白質和 DNA。交聯程序與時間有關,需要優化。
提示:樣本的建議交聯時間為 2~30 分鐘,過度交聯會降低抗原的可及性及超聲效果,表位也可能被掩蓋。加入甘氨酸封閉甲醛,終止交聯反應。
1.1 首先,準備 2×107~1×108 個細胞。直接向培養基中逐滴滴加甲醛,至終濃度為 0.75%,然后在室溫下輕柔旋轉 10 分鐘,促使蛋白質與 DNA 交聯。
1.2 向培養基中添加甘氨酸,至終濃度為 125 mM,室溫下振蕩孵育 5 分鐘。
1.3 用 10 mL 冰的 PBS 沖洗細胞 2 次。
1.4 加入 5 mL 冰的 PBS,刮下細胞,移入離心管中。
1.5 4 ℃,1 000 g 離心 5 分鐘。
1.6 小心吸取上清液,將沉淀重懸于 ChIP 裂解緩沖液中(每 107 個細胞加 750 μL),置于冰上孵育 10 分鐘。
2. 對細胞裂解液進行超聲處理,以分離染色質
2.1 對裂解液進行超聲處理以剪切 DNA,并確保 DNA 的平均片段大小為 200~1 000 bp。超聲處理時間需要優化。
2.2 超聲處理完成后,4 ℃,8 000 g 離心 10 分鐘,取上清液至新管中。
3. 計算 DNA 濃度,并測定 DNA 片段大小
經過超聲處理的染色質樣本可用于計算后續 IP 的 DNA 濃度,并電泳檢測 DNA 片段大小。
3.1 取 50 μL 經超聲處理的樣本,測定 DNA 濃度和片段大小。
3.2 向 50 μL 染色質中加入 70 μL 洗脫緩沖液。
3.3 加入 4.8 μL 5 M NaCl 和 2 μL RNase A(10 mg/mL),65 ℃ 下振搖孵育過夜。
3.4 加入 2 μL 蛋白酶 K(20 mg/mL),60 ℃ 下振搖孵育 1 小時。
3.5 使用 PCR 純化試劑盒或苯酚:氯仿萃取法純化 DNA。
3.6 為測定 DNA 濃度,取 5 μL 純化 DNA,轉移至含 995 μL TE 的試管中,稀釋 200 倍,并讀取 OD260。DNA 濃度 (μg/mL) 為 OD260×10 000。用于計算制備染色質的 DNA 濃度。在帶 100 bp DNA marker 的 1.5% 瓊脂糖凝膠中電泳純化 DNA,以測定片段大小。
4. 染色質免疫沉淀(IP)
4.1 使用步驟 2.2 制備的染色質。建議每次 IP 使用約 25 μg DNA。按 1:10 的比例用 RIPA 緩沖液稀釋每個樣本。設置一個 IgG 抗體對照和一個僅加磁珠的對照。取 50 μL 染色質作為 input 樣本,-20 ℃ 下保存備用。
4.2 在所有樣本(僅加磁珠的對照除外)中加入一抗,并在 4 度下旋轉孵育 1 小時。抗體用量應事先通過實驗確定;一般來說,每 25 μg DNA 加入 1~10 μg 抗體(最佳抗體是經 ChIP 驗證的抗體,IP 驗證次之,抗體量參考廠家推薦)。
4.3 制備蛋白 A/G 磁珠(按照實驗選擇適合磁珠)
4.4 在所有樣本中加入 60 μL 蛋白 A/G 磁珠,4 ℃ 下旋轉過夜。
4.5 2 000 g 離心 1 分鐘,除去上清液。
4.6 按照以下步驟進行洗滌:分別在低鹽洗滌緩沖液、高鹽洗滌緩沖液和氯化鋰洗滌緩沖液中洗滌一次。每次洗滌后,2 000 g 離心 1 分鐘,除去上清液。
5. 洗脫并解交聯
5.1 在蛋白 A/G 磁珠中加入 120 μL 洗脫緩沖液,以洗脫 DNA,30 ℃ 下緩慢渦旋 15 分鐘。
5.2 2000 g 離心 1 分鐘,并將上清液轉移至新管中。
5.3 加入 4.8 μL 5 M NaCl 和 2 μL RNase A(10 mg/mL),65 ℃ 下振搖孵育過夜。
5.4 加入 2 μL 蛋白酶 K(20 mg/mL),60 ℃ 下振搖孵育 1 小時。
5.5 DNA 可使用 PCR 純化試劑盒或苯酚-氯仿萃取法進行純化。
6. ChIP-seq 分析 DNA 水平
使用 ChIP-seq 方法時,通過測序進行 DNA 水平分析。使用該方案產生的 DNA 適合用作制備測序文庫的 input。
注意事項
1. 蛋白 A 和 G 磁珠對各種屬不同免疫球蛋白同種型的親和力不同,根據使用的 IP 抗體選用。
2. 如果觀察到高背景,可能需要增加洗滌步驟。也可以在步驟 4.2 之前,預先用蛋白 A/G 磁珠孵育 1 小時,去除與磁珠發生的非特異性結合。將上清液(經過超聲處理的染色質)轉移至一個新管中,然后按照步驟 4.2 對抗體和磁珠進行孵育。
常見問題
1. 為什么使用RNase A?
使用 PCR 純化試劑盒時,高水平的 RNA 會干擾 DNA 純化,因此需要使用 RNase A 處理樣本。否則純化柱吸附飽和時產物會大大減少。
2. 為什么使用蛋白酶 K?
用蛋白酶 K 處理樣本,可使鄰近脂肪與芳香族氨基酸羧基的肽鍵斷裂。從而破壞蛋白質和 DNA 之間的交聯,促進 DNA 的純化。
3. 染色質消化片段過大(>1 000 bp)或過小(<150 bp)。
過度交聯。交聯超過 10 分鐘可能會抑制染色質的消化。
添加至染色質消化的細胞不足。
不同細胞系所需的超聲處理時間不同。
4. 陰性對照 IgG-IP 和實驗組抗體 IP PCR 反應中產物的數量相等。
添加至 IP 反應的染色質過多或不足。或者,添加至 IP 反應的抗體過多。
5. 實驗組抗體 IP PCR 反應中無產物。
添加至 PCR 反應的 DNA 不足。
添加至 IP 反應的抗體不足。
抗體不適用于 IP。


