體液樣本游離核酸/病原微生物核酸提取
簡介
游離核酸(包括 cfDNA 和 cfRNA) 是指在生物體液中發現的游離于細胞外的核酸,游離核酸的來源分為內源性和外源性,可以是細胞凋亡釋放到體液中的內源性核酸,也可以是人體感染病原微生物后由微生物產生的外源性核酸。游離核酸可以用于癌癥的早期診斷、預后評估,也可以用于病原感染的診斷,根據實驗目的不同,采集體液樣本類型不同,核酸純化方案也有一定區別。
原理
體液樣本先經過高速離心去除細胞及細胞碎片等大分子物質,進行蛋白消化后,將核酸溶液轉移到硅膠膜柱上使核酸結合在柱膜上,經洗滌去除雜質后洗脫得到純凈的核酸。
由于游離核酸濃度較低,可以在緩沖液中加入 carrier RNA 去除靜電效應,保證核酸更好地吸附到純化柱上,提高洗脫效率。
材料與儀器
QIAamp Viral RNA Mini Kit (QIAGEN,用于病原微生物核酸提取,下文操作步驟基于此試劑盒)
QIAamp Circulating Nucleic Acid (QIAGEN,用于體液游離核酸提取)
離心機
加熱模塊或水浴鍋
1.5 ml 或 2 ml 離心管、無菌吸頭
一次性手套
乙醇(96%–100%)
步驟
1. 吸取 560 μl 準備好的 Buffer AVL–carrier RNA 至 1.5 ml 的離心管。
2. 加 140 μl 血漿、血清、尿液、細胞培養上清液,或其他無細胞體液至第 1 步準備好的管中。渦旋振蕩 15 s。為了保證裂解效率,請確保樣本與 Buffer AVL 徹底混勻為勻漿。只凍融過 1 次的冰凍樣本也可被處理。如樣本是拭子,請按照以下步驟處理:拭子置于離心管中,加入 400 μl Buffer ATL 浸潤樣本;56°C 振蕩孵育 15 min;吸取 140 μl 樣本加入第 1 步準備好的離心管
3. 室溫下(15°C–25°C)孵育 10 min。病毒顆粒在室溫下 10 min 后充分裂解。長時間的孵育無助于 RNA 的產量和質量。
4. 快速離心以去除附著于內壁與內蓋的水滴。
5. 加 560 μl 乙醇(96%–100%)至樣本中,短暫離心 15 s 混勻。混勻后,快速離心去除附著于內壁與內蓋的水滴。
6. 小心吸取 630μl 第 5 步獲的溶液至 QIAamp Mini column 上(柱子放置于 1 個 2 毫升的收集管內)。蓋上蓋子,6000 x g (8000 rpm)下離心 1 min。將 QIAamp Mini column 移至 1 個新的 2 ml 收集管,丟棄帶有流出液的舊管。離心建議程序:6000 x g (8000 rpm)下離心 1 min。
7. 小心打開蓋子,重復第 6 步操作。
8. 小心打開蓋子,加入 500 μl Buffer AW1。蓋上蓋子,6000 x g (8000 rpm)下離心 1 min。將 QIAamp Mini column 移至 1 個新的 2 ml 收集管,丟棄帶有流出液的舊管。
9. 小心打開蓋子,加入 500 μl Buffer AW2。蓋上蓋子全速離心(20,000 x g; 14,000 rpm) 3 min。直接進行第 11 步,或為了排除 Buffer AW2 的殘留機會,先進行第 10 步操作,再做第 11 步。
10. 將柱子放在一個新的 2 ml 收集管,丟到含有流出液的舊管。全速離心 1 min。
11. 將柱子放在 1 個干凈的 1.5 ml 的離心管,丟掉含有流出液的舊管。小心打開蓋子,加 60 μl 平衡好的 Buffer AVE 至膜上。蓋上蓋子,室溫下孵育 1 min。6000x g (8000 rpm)離心 1 min。RNA 在–20°C 或–70°C 下可以穩定保存至多 1 年。
注意事項
1. 游離核酸提取過程中,樣本收集和離心后,血漿(未經處理,或用肝素之外的抗凝劑處理)或血清可在 2°C–8°C 下儲存至多 6 h。如需長期保存,建議分裝后在–20°C 或 –80°C 保存。冷凍血漿或血清樣本不可反復凍融。反復凍融將會促使蛋白變性沉淀,降低核酸回收率。
2. 如果體液樣本需要長時間保持運輸,需要使用專門的游離核酸采血管,常規的肝素、ETDA、枸櫞酸鈉采血管無法有效防止溶血,gDNA 會污染游離核酸。
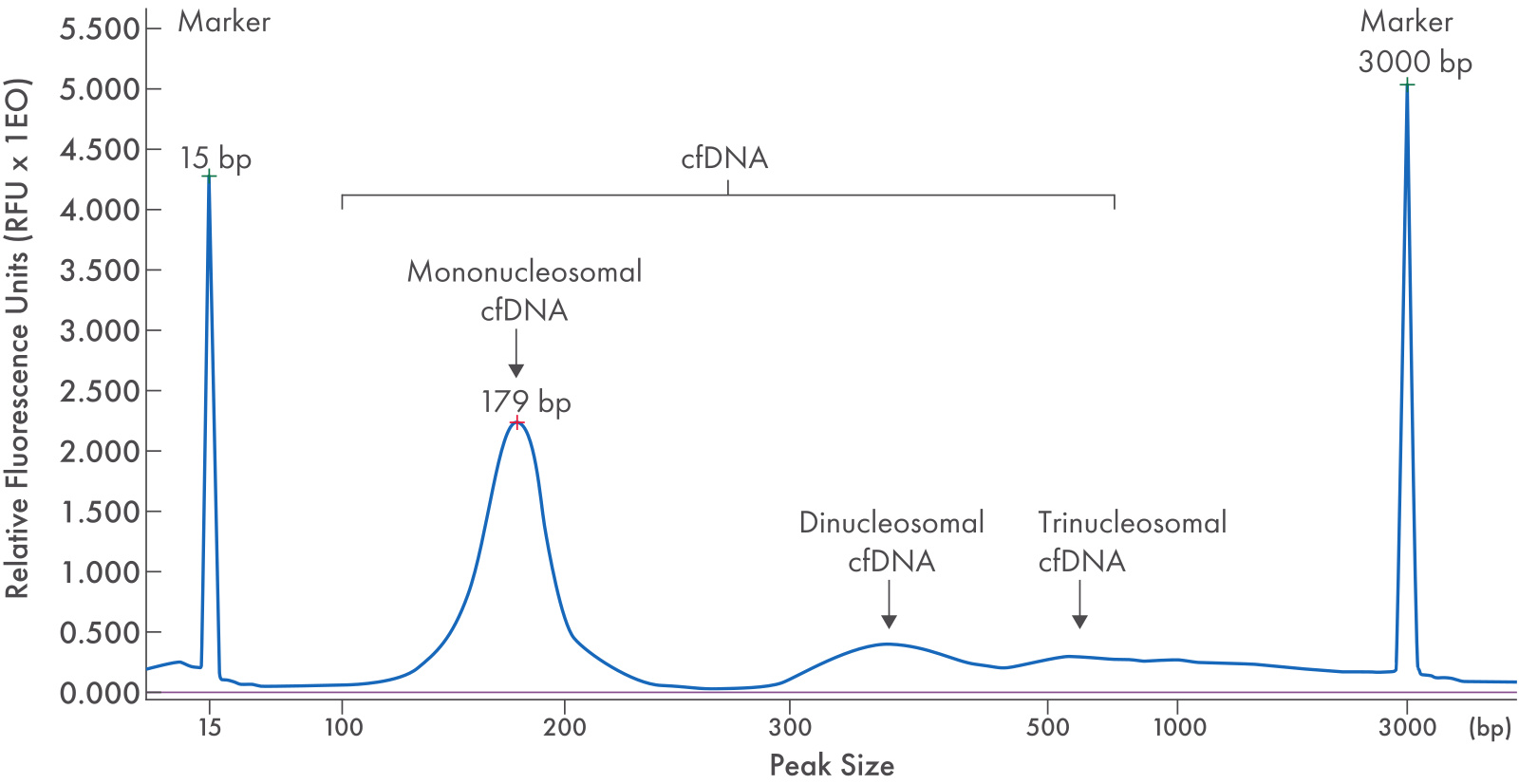
3. cfDNA 的濃度常常很低,Qubit 定量可能無法檢測到信號,且核酸處于片段化狀態,您需要高靈敏度且可靠的工具才能確保檢測到信號的準確性。
4. 單次 60 μl Buffer AVE 處理 QIAamp Mini column 可以達到至少 90% 的病毒 RNA 洗提效率。2 次 40 μl Buffer AVE 洗提可以提高 10% 的產量。洗提體積小于 30 μl 會減少產量,也不會增加最終洗提液中 RNA 的濃度。


