微量 RNA 建庫測序方案
簡介
RNA 測序 (RNA Sequencing,簡稱 RNA-Seq) ,是基于高通量測序技術的轉錄組學研究方法,可以快速對基因組中的 RNA 種類和數量進行分析,揭示特定生物學或疾病發生過程中的分子機制。RNA 文庫制備通常需要 100 ng 以上的起始 RNA,然而實際的科研實驗中常會遇到樣本本身較少或類型特殊,導致 RNA 起始量不足的情況,給建庫實驗帶來極大的挑戰。本章內容我們將為大家介紹微量 RNA(單細胞或低至 10 pg RNA)的特殊建庫方案。
原理
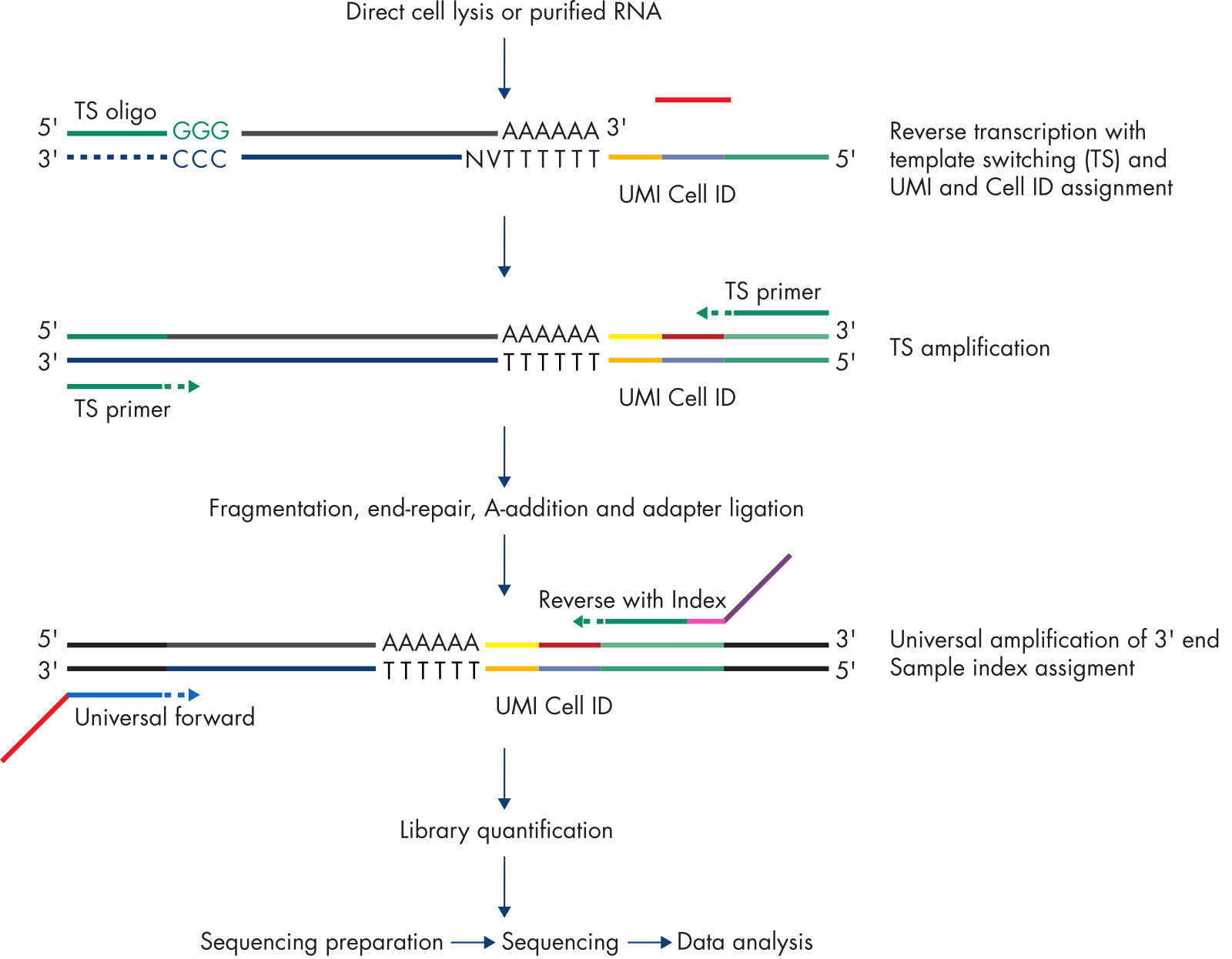
針對單細胞/微量細胞(1-1000 cells)轉錄組測序,目前使用的是 SMART 擴增技術。
具體步驟及反應原理如下:
1、使用 oligo dT 針對 RNA 聚合酶 II 轉錄的 RNA(具有 polyA 結構)進行逆轉錄(從而避開 rRNA);
2、逆轉錄到 5 cap 的時候,逆轉錄酶的末端轉移酶活性會不依賴于 RNA 模板, 在 cDNA 的末端加上多個 C(一般是 3 個);
3、然后使用一個帶有 GGG 的接頭(圖中的 TS oligo)與 CCC 進行配對,利用逆轉錄酶的 template switch 特征,繼續以這個 TS oligo 為模板合成 DNA。這樣 cDNA 的 3』就會加上 TS oligo 的序列;
4、進而以 TS oligo 配對的引物,對這個 cDNA 分子進行擴增。通過此方式,就可以將全長 RNA 進行指數擴增;
5、然后對擴增獲得的 DNA 分子進行文庫構建、測序及數據分析。
材料與儀器
QIAseq UPX 3' Transcriptome Kit (QIAGEN,低至單細胞或 10 pg RNA 的 3' RNA-seq 建庫試劑盒)
QIAseq UPXome RNA Lib Kit (QIAGEN,低至 500 pg RNA 全轉錄組建庫試劑盒,下文實驗步驟基于此試劑盒)
1.5 ml 或 2 ml 離心管、無菌吸頭
一次性手套
乙醇(96%–100%)
純化磁珠與磁力架
離心機
Vortex 漩渦震蕩儀
PCR 儀
步驟
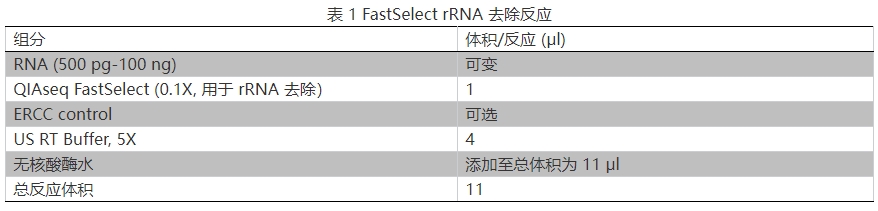
1.按表 1 準備 rRNA 去除反應體系,輕微震蕩混勻。
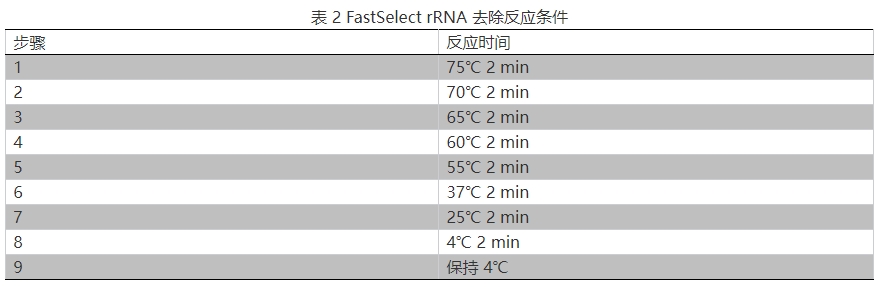
2.按表 2 進行反應:
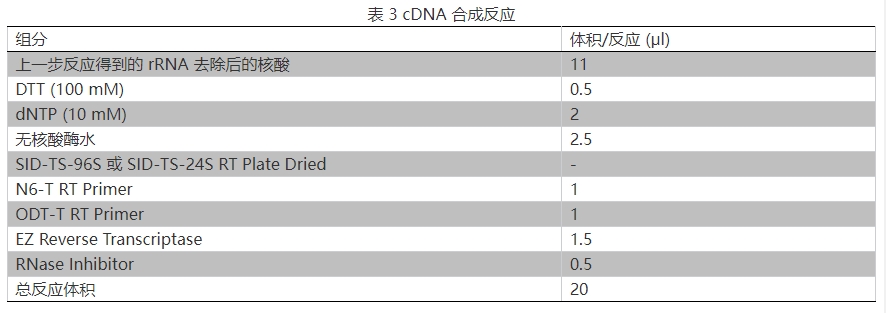
3.按表 3 準備 cDNA 合成反應體系,輕微震蕩混勻。
4.將 cDNA 合成反應組分加入到 SID-TS-96S 孔板中,輕微震蕩混勻并離心。
5.按表 4 進行反應:
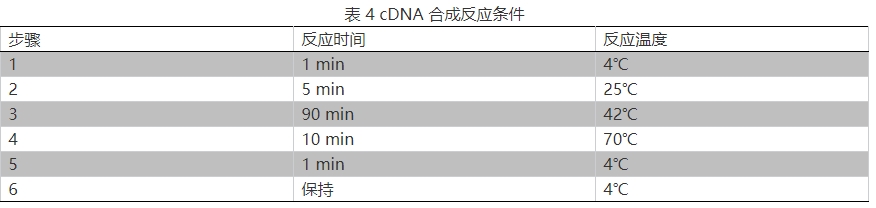
6.合成后的 cDNA,可以選 8—24 個放于 1 個 2 ml 離心管中,多個 cDNA 可以混合構建一個文庫。
7.加入 1.1X 體積的 QIAseq beads 對 cDNA 產物進行純化。
8.室溫孵育 5min
9.將反應管放置于磁力架上,使磁珠聚集直到液體變澄清(約 2min),小心移去上清。
10.將反應管放置于磁力架上,加入 200 μl新鮮配制的 80% 乙醇清洗磁珠,小心吸除乙醇,勿干擾磁珠。
11.重復第 14 步的乙醇洗滌一次。
12.在磁力架上孵育 5—10min 或至磁珠晾干,磁珠過度干燥可能會導致 DNA 產量降低。
13.使用 22μl 的無核酸酶水來重懸磁珠,將反應管放置于磁力架上,使磁珠聚集直到液體變澄清,小心吸取 20 μl 的上清至新的 PCR 板中。
14.向每個樣本中加入 22μl(1.1X)重懸后的磁珠。重復第 8-12 步。使用 25 μl 的無核酸酶水來重懸磁珠,將反應管放置于磁力架上,使磁珠聚集直到液體變澄清,小心吸取 23 μl 的上清至新的 PCR 板中。
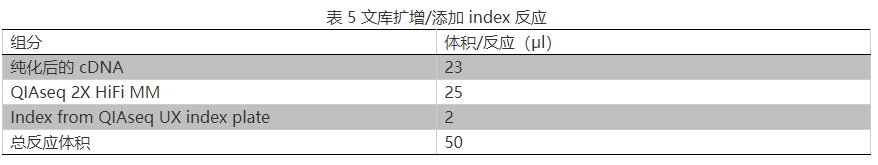
15.按表 5 步驟進行 PCR 儀(需帶有熱蓋)程序設定
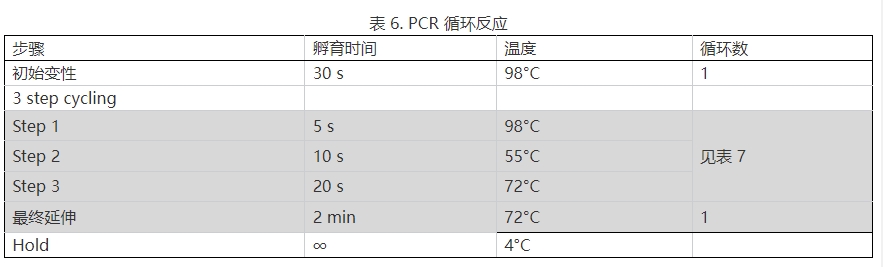
16.按表 6 設置 PCR 循環反應,PCR 循環數參考表 7。

17.加入 40 μl磁珠進行純化,室溫孵育 5min
18.將反應管放置于磁力架上,使磁珠聚集直到液體變澄清(約 2min),小心移去上清。
19.將反應管放置于磁力架上,加入 200 μl新鮮配制的 80% 乙醇清洗磁珠,小心吸除乙醇,勿干擾磁珠。
20.重復第 19 步的乙醇洗滌一次。
21.在磁力架上孵育 5—10min 或至磁珠晾干,磁珠過度干燥可能會導致 DNA 產量降低。
22.使用 22μl 的無核酸酶水來重懸磁珠,將反應管放置于磁力架上,使磁珠聚集直到液體變澄清,小心吸取 20 μl 的上清至新的 PCR 板中。
23.向每個樣本中加入 16μl(0.8X)重懸后的磁珠。重復第 18-22 步。使用 24 μl 的無核酸酶水來重懸磁珠,將反應管放置于磁力架上,使磁珠聚集直到液體變澄清,小心吸取 22 μl 的上清至新的 PCR 板中。純化后的文庫可保存在-20°C 直至測序。
注意事項
1. SMART 技術的轉錄酶具有末端轉移酶活性,單管反應一步完成逆轉錄和二鏈合成,不需要額外的 cDNA 純化和二鏈合成反應,簡化了建庫流程并節省了操作時間。
2. 微量建庫測序能否成功,在實驗方面一個重要的因素就是降低核糖體在 Total RNA 中的比例。使用 polyT 引物反轉錄雖然能避免 rRNA,但是很難獲得全長 RNA 數據。本方案結合了 rRNA 去除「黑科技」QIAseq FastSelect,整個 rRNA 去除反應完美融入逆轉錄步驟中,無需任何操作以及額外純化步驟。這一「黑科技」可將總 RNA 中的 rRNA「封閉」住,使其不能進行反轉錄、二鏈合成等反應,最終無法進入構建好的 NGS 文庫,顯著降低 rRNA 干擾,減少測序成本的同時降低數據分析難度并提高結果的準確性。且這一方法不受起始樣本量限制,低至單細胞裂解釋放的 RNA 都可以進行 rRNA 去除。
3. 當 RNA 起始量較低時,測序所需的數據量也不必過高,每個樣本單獨構建文庫既浪費建庫試劑,又增加了操作時間。本方案支持 8—24 個 cDNA 混合建庫,只要將不同樣本反轉錄得到的 cDNA 混合純化,構建一個混合 RNA-seq 文庫即可。高通量測序后,根據反轉錄時引入的樣本標簽(Sample ID)拆分出每個樣本的基因表達信息即可,節省成本的同時也提高了實驗效率。


