雙熒光素酶報告基因檢測
一、 檢測原理
全基因合成miR潛在結合位點上下游~500bp(LncRNA、circRNA或mRNA的3’UTR)野生形式WT及結合位點的突變形式Mut,克隆到psiCHECK-2多克隆位點處(1640-1674)(圖1),然后與miR的mimics/NC共同轉染293T細胞測定熒光素酶讀值即可。
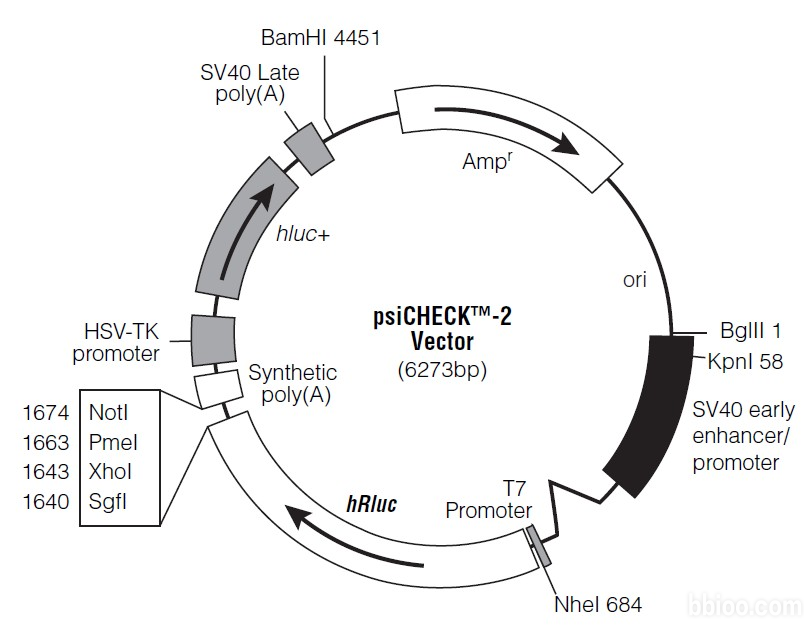
圖1 雙熒光素酶載體示意圖.
二、 載體構建與Mimics合成
1. 構建WT miR潛在結合位點到psiCHECK-2載體,命名為WT;
2.構建Mut miR潛在結合位點到psiCHECK-2載體,命名為Mut(突變模式:A/T與G/C互變);
3.合成待測miR的Mimmics及陰性對照NC。
三、 實驗分組信息
psiCHECK- Target 序列 | miR | ||
Target-1 | 1 | WT | NC |
2 | WT | Mimics | |
3 | Mut | NC | |
4 | Mut | Mimics | |
Target-2 | 1 | WT | NC |
2 | WT | Mimics | |
3 | Mut | NC | |
4 | Mut | Mimics |
四、 具體實驗步驟:
(一) 細胞轉染操作步驟
1.事先準備好用于轉染的分到96孔板中的293T 細胞和目的質粒,待細胞密度達到50%-70%為宜。
2.將10 ml DMEM與0.16 mg的lncRNA (circRNA/3’UTR)/Mut目的質粒以及5 pmol的miR/Negative.Control(N.C)Mimics充分混勻后室溫放置(溶液A);然后將10 ml DMEM與0.3 ml 的轉染試劑(轉染試劑為漢恒生物產品LipoFiter,濃度為0.8 mg/ml)充分混勻(溶液B),室溫放置5 min。
3.將溶液A與溶液B充分混勻,室溫放置20 min。
4.轉染前為細胞換取新鮮培養基,之后將轉染混合物加入混勻。37℃,5% CO2培養。
5.轉染6 h后換取新鮮培養基,轉染48 h后收集細胞檢測。
(二) 檢測實驗操作步驟
檢測試劑盒:Promega Dual-Luciferase system
1、將5′PLB (Passive Lysis Buffer)用蒸餾水稀釋至1′PLB,以96孔板每孔100 ml的量加入,用移液槍吹打打散細胞,置于室溫搖床上緩慢搖15分鐘后,將細胞裂解液吸至1.5 ml離心管,4度12000 rpm (13200g)離心10 min,取上清移入新的管子;
2、96孔板中加入Luciferase Assay Reagent II (LAR II)( Luciferase Assay Reagent, Progema)工作液100 ml;
3、加入20 ml細胞裂解液,移液槍吹打混勻2-3次,測定記錄Firefly luciferase值,此值為內參值。
4、加入100 ml Stop & Glo? Reagent(Luciferase Assay Reagent, Progema),移液槍吹打混勻2-3次,測定記錄Renilla luciferase值,此即為報告基因發光值。
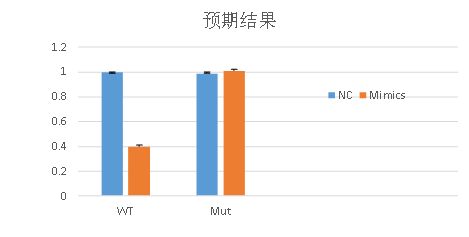
五、 預期實驗結果