微量細胞 DNA 和 mRNA 共提取
簡介
低至單個細胞的 DNA&mRNA 共提取方案,起始樣本支持顯微切割細胞、流式分選細胞、循環腫瘤細胞(CTCs)、胎兒細胞、干細胞、T 細胞等。
原理
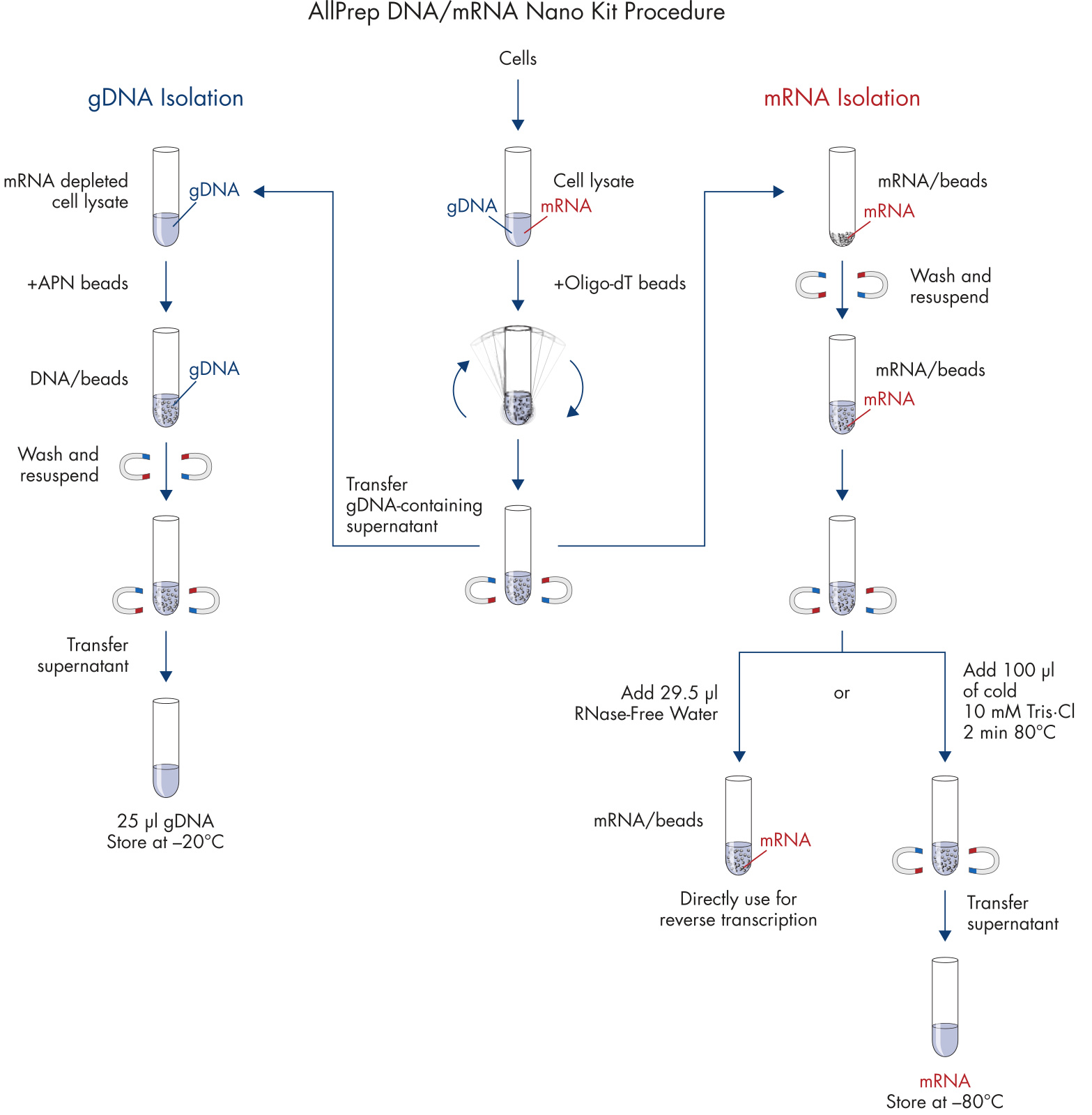
細胞裂解后釋放出基因組 DNA 和 mRNA,利用 Oligo-dT 磁珠將 mRNA 與裂解后液體中的基因組 DNA 分離開來,分別進行基因組 DNA 與 mRNA 的純化。對富集有 mRNA 的磁珠進行雜質洗滌后即可洗脫得到 mRNA。與此同時,可利用另一款 APN 磁珠對基因組 DNA 進行富集,同樣洗滌掉雜質后可洗脫獲得基因組 DNA。兩步磁珠法技術可幫助最大限度捕獲更長片段的基因組 DNA 和 mRNA,用于長片段擴增、多重 PCR、數字 PCR、三代測序等應用。
材料與儀器
AllPrep DNA/mRNA Nano Kit (QIAGEN)
離心機
加熱模塊或水浴鍋
0.2 ml、1.5 ml 或 2 ml 離心管、無菌吸頭
一次性手套
乙醇(96%–100%)
步驟
從循環腫瘤細胞中提取基因組 DNA 和 mRNA,細胞在 200 μl AdnaTest 裂解/結合緩沖液(提供)中進行裂解。
mRNA 提取:
1. 向含有細胞裂解物的每個離心管中加入 20 μl Oligo(dT)磁珠。
2. 在允許傾斜和旋轉的設備上,在室溫下緩慢旋轉管子(約 5 rpm)10 min
3. 將離心管放入不帶磁極的 AdnaMag-S 中。向下擺動 AdnaMag-S 以釋放蓋子中捕獲的磁珠和液體。
4. 插入磁極,1 min 后,將含有 DNA 的上清液轉移到新的 1.5 ml 離心管(提供)中,并在 4°C 下儲存直至使用。
5. 用 RNA 純化緩沖液 A 洗滌。
6. 用 RNA 純化緩沖液 B 洗滌。
7. 從 AdnaMag-S 上取下磁極。
8. 向每個離心管中加入 100 μl 冰冷的 Tris·Cl 緩沖液,用移液器重懸磁珠。
9. 將磁極插入 AdnaMag-S。
10. 1 min 后,完全除去上清液。
11. 從 AdnaMag-S 上取下磁極。
12. 根據下游應用的不同,請按照以下兩個選項之一進行操作。
以不帶磁珠的 cDNA 合成為例:加入 10–20 μl 冷的 10 mM Tris·Cl. 加熱至 80°C ,2 min,然后立即將試管放在磁極上。將洗脫的 mRNA 快速轉移到新的無 RNase 管中,然后繼續進行下游應用或在 ?80°C 下儲存。
基因組 DNA 提取:
13. 準備洗脫緩沖液 AVE/APN。對于每個樣品,將 22.4 μl 緩沖液 AVE 與 7.6 μl 洗脫緩沖液 APN 混合。
14. 向含有第 4 步細胞裂解物的每個離心中加入 600 μl RNase-Free Water。
15. 加入 40 μl 蛋白酶 K,渦旋 3 次,并在 56°C 下孵育 10 min。
16. 加入 150 μl 結合緩沖液 APN。
17. 向每個樣品中加入 30 μl 磁珠懸浮液 APN。
18. 室溫下緩慢旋轉孵育(約 5 rpm)10 min。
19. 將試管放入不帶磁極的 AdnaMag-S 中。向下擺動 AdnaMag-S 以釋放蓋子中捕獲的磁珠和液體。
20. 插入磁極,30 s 后,除去上清液。
21. 用緩沖液 APN1 洗滌。
22. 用緩沖液 APN2 洗滌。
23. 從 AdnaMag-S 上取下磁極,取下反應管,并短暫離心。
24. 將反應管放回 AdnaMag-S 架子中,并將磁極插入 AdnaMag-S。
25. 30 s 后,完全去除殘留的洗滌緩沖液。
26. 通過重復移液(5x)將磁珠重懸于 25 μl 洗脫緩沖液 AVE/APN 中,并在室溫下孵育 1 min。
27. 短暫離心。
28. 將反應管放入 AdnaMag-S 中,并將洗脫液轉移到新的 1.5 ml 管中。
29. 將裝有 gDNA 的反應管放在冰上進行后續分析,或儲存在 -30 至 -15°C 下。


