水稻植物中目的蛋白的亞細胞定位
簡介
利用特定標記蛋白比如綠色熒光蛋白(GFP)或 β-葡萄糖苷酸酶(GUS)標記目的蛋白,隨后通過免疫熒光或者 GUS 染色檢測其分布位置。
原理
目前最常用的是融合報告基因定位,將目的蛋白與熒光蛋白的 N 端或者 C 端融合,通過瞬時轉化或穩定遺傳轉化技術,使該融合蛋白在受體細胞中表達,目的蛋白與熒光蛋白一起定位到目標細胞器。隨后在共聚焦顯微鏡的激光照射下,融合蛋白會發出特定顏色的熒光,從而精確地定位目的蛋白質的位置。
用途
借助亞細胞定位,可以判斷蛋白質或其表達產物在細胞中的具體位置,為研究基因的作用機制提供研究方向,如與酵母雙雜相互驗證來研究蛋白互作等。
材料與儀器
本實驗方法以借助 GFP 在水稻中的定位為例進行介紹:
1、載體和植物材料:PAN580-GFP 載體、秈稻 9311 的種子等;
2、主要試劑:甘露醇、MES、纖維素 R-10、Macerozyme R-10、BSA、羧卞青霉素、β-ME、PEG 4 000、CaCl2、NaCl、KCl、MgCl2、葡萄糖等;
3、所需用品和儀器:50 ml 離心管、50 ml 注射器、刀片、尼龍濾布(200 目)、0.45 μm 微孔濾膜、血球計數板、載玻片、蓋玻片、低溫離心機、真空泵、分光光度計、激光共聚焦顯微鏡等。
步驟
0. 試劑配制
1) 酶解液(10 ml)
0.6 M 甘露醇 | 1.093 g |
10 mM MES(pH=5.7) | 1 ml(100 mM 母液) |
1.5% 纖維素 R-10 | 0.15 g |
0.75% Macerozyme R-10 | 0.075 g |
0.1% BSA | 0.01 g |
1 mM CaCl2 | 0.1 ml(100 mM 母液) |
0.25 g/ml 羧卞青霉素 | 2 μl |
β- ME | 4 μl |
ddH2O 定容至 10 ml,55 °C、10 min 自然冷卻(須現配現用)。
2) PEG 4000(10 ml)
0.6 M 甘露醇 | 1.093 g |
100 mM CaCl2 | 0.111 g |
40% PEG 4000 | 4 g |
ddH2O 定容至 10 ml,1M KOH 將溶液 pH 值調至 7.5~8.0,過濾除菌后 1.5 ml 離心管分裝后保存在 -20 °C 冰箱中。
3) W5(100 ml)
154 mM NaCl | 0.9 g |
125 mM CaCl2 | 1.39 g |
5 mM KCl | 5 ml(100 mM 母液) |
5 mM 葡萄糖 | 0.09 g |
2 mM MES | 2 ml(100 mM 母液) |
1M KOH 將溶液 pH 值調至 5.8,高溫高壓滅菌 20 min,室溫保存。
4) MMG(10 ml)
15 mM MgCl2 | 1.5 ml(100 mM 母液) |
4 mM MES | 0.4 ml(100 mM 母液) |
0.6 M 甘露醇 | 1.093 g |
1M KOH 將溶液 pH 值調至 5.8,高溫高壓滅菌 20 min,室溫保存。
1. 目的蛋白預測
目的蛋白的定位可以通過一些在線網站進行預測,在此推薦幾個植物常用的預測網站:
WoLF PSORT: Protein Subcellular Localization Prediction Tool(genscript.com)
iPSORT Home Page(hgc.jp)
Services list(dtu.dk)
TargetP 2.0 - DTU Health Tech - Bioinformatic Services
2. 構建包含目的基因的載體
本實驗所用的載體為帶有 GFP 標簽的 PAN580 載體,其載體圖如下圖所示:
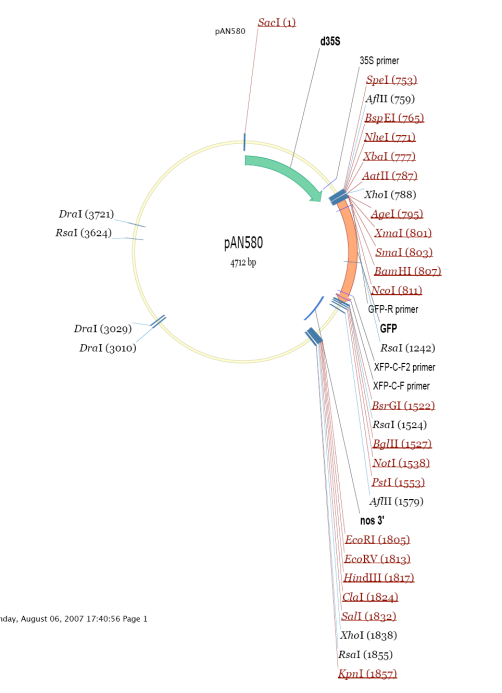
載體構建方法為雙酶切+同源重組(基因在 GFP 上游的引物設計時需要去除終止密碼子),測序無誤后大提質粒,最終質粒濃度應在 1 000 ng/ul 以上,建議不低于 800 ng/ul。
3. 水稻種植
挑選外觀飽滿、大小一致的秈稻 9311 種子若干,30 ℃ 下浸種 2 天,催芽 12 h 后播種,在 10 h 光照/14 h 黑暗、28 °C、光照強度為 10 000 lx 的光照培養箱中培養數日至苗長高至 10 cm 左右。
4. 原生質體提取
1) 幼苗連根拔起,切去根部并清洗干凈,從根基開始,選擇白色堅實的莖部分,切成盡可能短的小段,稱重后倒入干凈的 100 ml 錐形瓶中,1 g 幼苗小段加入 10 ml 酶解液;
2) 抽真空 45~60 min,28 ℃、40 rpm 培養箱中震蕩培養 4~5 h(注意避光);
3) 尼龍膜(200 目)過濾酶解液至滅菌的 50 ml 離心管內,置于 28 ℃ 培養箱中備用;
4) 濾渣中加入 10 ml W5 溶液,28 ℃、80 rpm 培養箱中震蕩培養 1 h,充分釋放原生質體;
5) 再次用尼龍膜(200 目)過濾,與步驟 3 中的濾液充分混合,并加入等體積的 W5 溶液,150 g 室溫離心 5 min(升降速均選擇輕柔模式),棄上清;
6) 加入 1 ml 重懸液重懸后,緩慢加入 20 ml 20% 蔗糖溶液,使原生質體懸浮于蔗糖溶液中,120 g 離心 5 min(升降速均選擇輕柔模式);
7) 收集分層界面處的原生質體,W5 溶液洗凈后,冰上孵育 30 min,以 100 g 離心 5 min 沉淀原生質體,棄上清,盡可能去除殘留液體后,輕輕加入 1 ml MMG 溶液重懸原生質體,顯微鏡下將原生質體密度調整為 2×105 cells/ml。
5. 質粒轉化與觀察結果
(1) 在滅菌的 2.0 ml EP 管中加入 10 μl(10~20 μg)包含目的片段的重組質粒,小心加入 150 μl 原生質體,輕搖混勻;
(2) 加入 150 μl 40% PEG,輕搖混勻,28 ℃ 培養箱中孵育 20 min;
(3) 緩慢加入 500 μl W5 溶液,小心混勻,150 g 離心 4 min(注意離心管的擺放方向),槍尖吸除 PEG;
(4) 緩慢加入 100 μl W5 溶液重懸,28 ℃ 培養箱中黑暗培養 12 h 以上;
(5) 激光共聚焦顯微鏡下觀察熒光蛋白的表達情況。
注意事項
1、構建載體時需要注意 GFP 標簽的融合位置,若目的序列中存在信號肽,構載體時需避開這一端來融合熒光蛋白,因為不同的融合方式可能會觀察到不同的定位情況,影響實驗結果;
2、不同物種的表達情況會稍有差別,所以會出現不同受體物種中的定位不同的情況,在選擇受體時,應盡量選擇與目的蛋白或基因的序列來源相近的物種材料(如水稻蛋白常選在水稻、洋蔥表皮和煙草中進行);
3、建議提供 GFP 空載作為空白對照,證明該熒光蛋白在實驗中能夠正常行使功能,同時排除實驗操作中目的蛋白受熒光信號的影響;
4、建議增設一個明場通道,說明原生質體是活性狀態良好的活細胞,同時說明熒光信號是由融合蛋白而非細胞碎片產生的。
5、本實驗所用的 PAN580 載體上攜帶有 35 S 強啟動子,建議同時構建基因自身啟動子融合 GFP 的載體,避免定位結果受到基因表達水平的干擾。
常見問題
1. 水稻原生質體得率和活率較低:原生質體得率低可能是酶解液未能很好的接觸植物切口,如水稻莖段不易浸入酶解液中,因此要切成盡可能的小段以及通過抽真空的方式增大酶解液與切口的接觸面積、促進酶解液進入植物組織;原生質體活率較低可能是操作過程中避光不嚴密所致,光照會會原生質體膜造成傷害,導致其活率較低。
2. 觀察不到熒光:不同物種的細胞可能對基因表達存在不同的影響,建議更換受體材料來觀察熒光,如煙草等。


